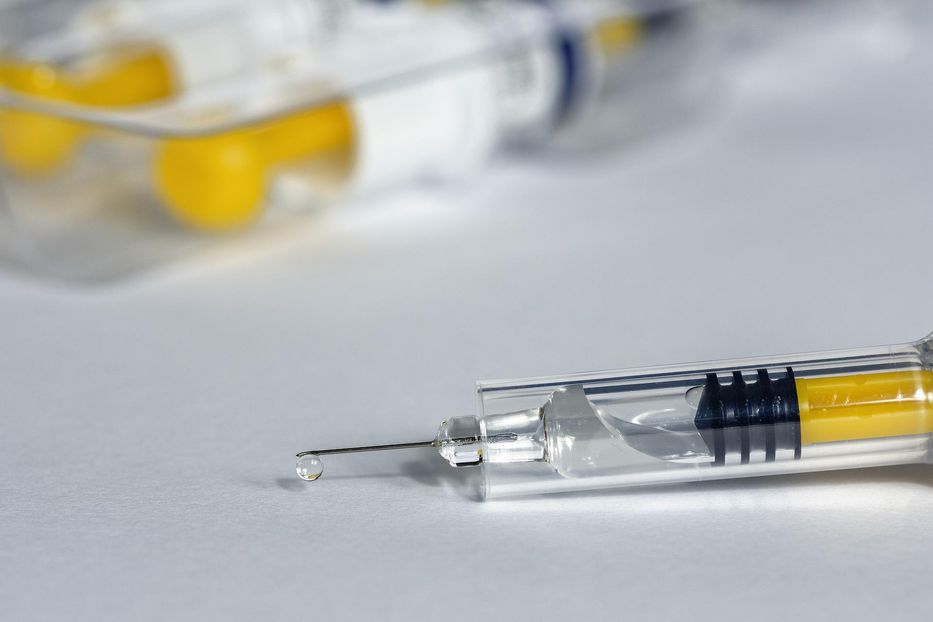
La empresa farmacéutica Moderna informó el miércoles que la Administración de Alimentos y Medicamentos (FDA) de Estados Unidos dio marcha atrás con su postura y aceptó revisar la nueva vacuna de la compañía contra la gripe basada en ARN mensajero.
La semana pasada, el organismo regulador federal rechazó la solicitud de la firma estadounidense para la revisión de la nueva vacuna, al calificar de insuficiente su ensayo clínico.
Pero Moderna señaló que, tras una reunión “constructiva”, la FDA aceptó la solicitud de revisión sobre la base de una vía regulatoria centrada en los adultos mayores. “Pendiente de la aprobación de la FDA, esperamos poner nuestra vacuna contra la gripe disponible a finales de este año para que los mayores de Estados Unidos tengan acceso a una nueva opción para protegerse contra la gripe”, sostuvo el comunicado.
Según se espera, la resolución final podría estar disponible el 5 de agosto de este año.
La negativa inicial de la FDA había generado revuelo en el sector farmacéutico, ya alarmado por las políticas antivacunas del secretario de Salud estadounidense, Robert Kennedy Jr.
El rechazo inicial fue atribuido a Vinay Prasad, el principal controlador de vacunas del gobierno de Donald Trump. Según informó días atrás The Wall Street Journal, funcionarios de carrera de la FDA mostraron su disconformidad respecto a la idea de ni siquiera considerar la vacuna antigripal de Moderna, ya que no considerarla sería una estrategia incorrecta.
Con información de AFP.

Acerca de los comentarios
Hemos reformulado nuestra manera de mostrar comentarios, agregando tecnología de forma de que cada lector pueda decidir qué comentarios se le mostrarán en base a la valoración que tengan estos por parte de la comunidad. AMPLIAREsto es para poder mejorar el intercambio entre los usuarios y que sea un lugar que respete las normas de convivencia.
A su vez, habilitamos la casilla [email protected], para que los lectores puedan reportar comentarios que consideren fuera de lugar y que rompan las normas de convivencia.
Si querés leerlo hacé clic aquí[+]